近日,我校基础医学与临床药学学院于烨教授团队研究团队在膜受体非经典的偏好性信号调控方向取得研究进展,部分研究成果近期已在Neuron, Nat Commun, eLife等期刊发表。
研究发现,存在于细胞表面的膜受体作为主要的生理传感器,涵盖了视觉、嗅觉、温度和压力感知等众多受体,具有多种对细胞和生物组织至关重要的生物功能。许多疾病均与膜蛋白功能异常有关,使其成为了药物开发领域的重要靶点。目前,超过50%的小分子药物以人类膜蛋白为靶标,G蛋白偶联受体 (GPCRs) 和离子通道两类膜受体位列前二(图1)。膜蛋白受体的偏好性/精细变构提供了新的时间和空间信号,通过优先稳定受体的不同活性构象状态来诱发不同的细胞信号传导。这种更为精细的调控或许能够限制副作用的发生,使得更多“不可成药”的膜蛋白成为治疗靶标,并将其治疗效果与副作用得以分离。
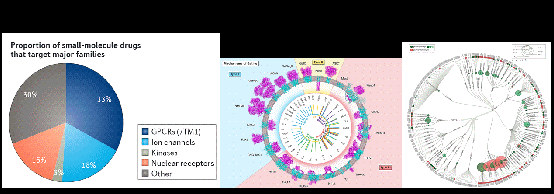
图1.目前上市的小分子药物中, 50%以上是以人类膜蛋白为靶标的,其中G蛋白偶联受体 (GPCRs) 和离子通道两类膜受体位列前二(图片来源:Hauser et al.,Nat Rev Drug Discov, 2017,Baron Chanda, et al. Cell,2017;Santos R et al., Nat Rev Drug Discov, 2017)。
辣椒素(香草素)受体TRPV1是一种非选择性阳离子通道。最初,David Julius教授在探索辣椒素引起痛觉的机制时发现了TRPV1。随后,Julius教授在研究TRPV1如何感知热量时意识到,TRPV1还是一种热敏受体——在感受痛觉的温度下,受体被激活。目前,多种TRPV1拮抗剂候选药物进入了临床试验阶段。不过,TRPV1激动剂/拮抗剂的研发面临一大挑战,即它们往往会引起人体核心体温的剧烈变化,这极大限制了相关药物的使用可能性。至今,为何TRPV1靶向药物在镇痛的同时会引起核心体温的剧烈变化,其中的分子机制尚不清楚。基临院于烨教授领衔的膜生物物理与化学生物学课题组成员在《Neuron》上在线发表的题为“TRPV1 analgesics disturb core body temperature via a biased allosteric mechanism involving conformations distinct from that for nociception”论文为我们解答了这一问题。该项研究工作首次提出TRPV1中在同一位点结合不同配体的细微差别编码了痛觉和体温调节的功能。这一发现挑战了将受体视为简单开与关的传统观点,并突出了通道蛋白也存在连续、偏好性信号编码的受体复杂性,为研发TRPV1靶向且不改变体温的非阿片类镇痛药物研发提供了扎实的基础(图2)。中国药科大学博士生黄毅哲、博士后孙萌阳、硕士生马静娴、博士生边宇婧为本文的主要贡献者。全文链接如下:https://doi.org/10.1016/j.neuron.2024.02.016
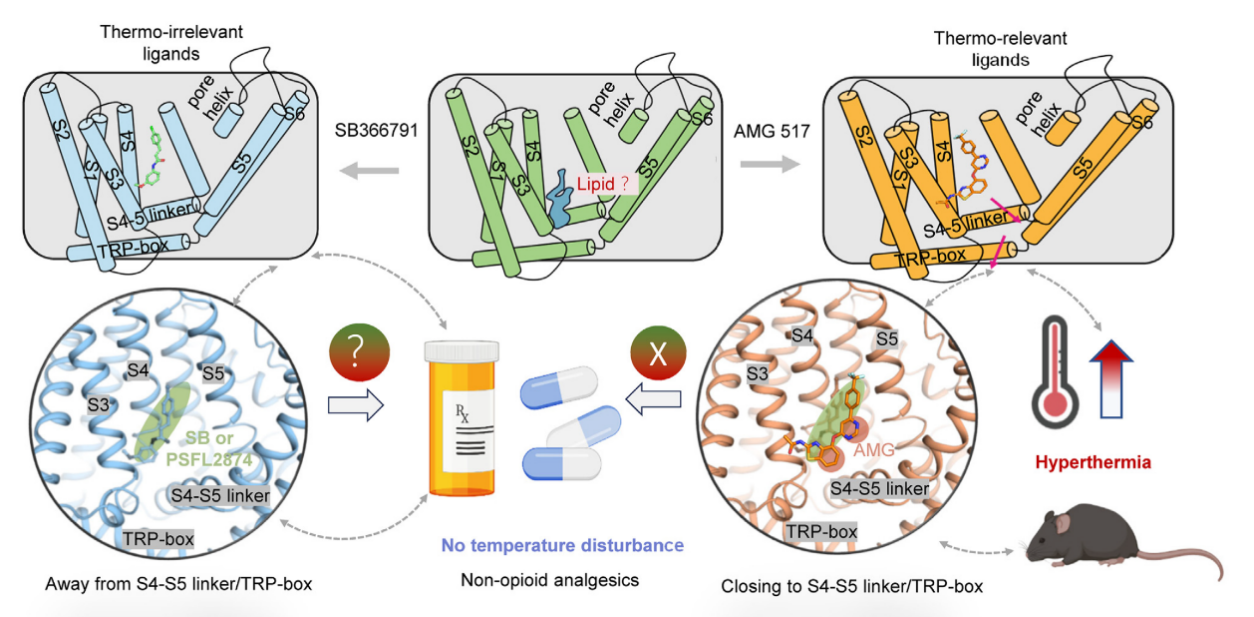
图2. 离子通道的配体在同一位点的微小差异也可介导偏好性信号编码(图片来源:Huang YZ et al., Neuron, 2024. 6)
与TRPV1镇痛策略相似,针对P2X3受体为靶标的镇咳药物在止咳同时常伴随有味觉失调等副作用的问题,该团队利用电压钳荧光法联合全细胞膜片钳等技术,发现了P2X3受体新的变构调节机制,并基于该机制开发得到了新的P2X3受体拮抗剂,通过多种动物模型对其止咳药效和副作用进行了评价,证实该化合物可以在靶向P2X3受体发挥止咳作用的同时降低味觉失调副作用。相关成果以“Chronic cough relief by allosteric modulation of P2X3 without taste disturbance”为题发表于《Nature Communications》杂志。这一发现为靶向P2X3受体治疗难治性慢性咳嗽的药物开发提供了一种新策略。本文的主要贡献者为郭常润副教授,湖南师范大学联合培养硕士研究生张忠哲,中国药科大学硕士研究生周杏。全文链接如下:https://www.nature.com/articles/s41467-023-41495-0

图3. 靶向P2X3受体治疗难治性慢性咳嗽的药物开发提供的新策略(图片来源:Guo CR et al., Nat Commun, 2023.12)
在P2X受体的调节机制方面,该团队同时与复旦大学服部素之团队联合在《eLife》杂志在线发表题为“Structural insights into the orthosteric inhibition of P2X receptors by non-ATP-analog antagonists” 的文章,利用单颗粒冷冻电子显微镜技术结合电生理实验,解析了P2X7受体与两种磷酸吡哆醛衍生物的复合物结构,并分析了这两种正构拮抗剂对P2X7受体的调节作用和机制,为P2X7亚型特异的药物设计提供结构信息。参与本文的中国药科大学的主要贡献者为郭常润副教授,中国药科大学硕士研究生岳晨茜。全文链接如下:https://elifesciences.org/articles/92829
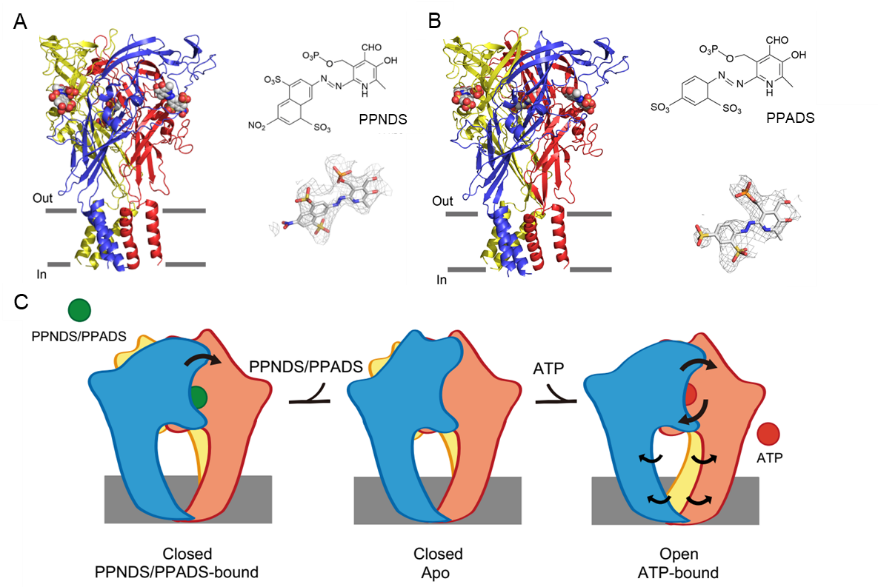
图4. 靶向P2X3受体治疗难治性慢性咳嗽的药物开发提供的新策略(图片来源:Sheng DS et al., eLife, 2024.4)
基础医学与临床药学学院于烨教授领衔的膜受体功能与调控团队,长期从事神经、免疫与心血管系统重大疾病相关膜蛋白跨膜信号转导过程中的关键生物物理问题,疾病的发病机制,新药候选分子发现及新技术、新方法的建立等方面的研究。自团队2018年11月加入中国药科大学来,团队成员已在Neuron(2024),Nat Commun(2023a, 2023b),eLife(2024, 2022),J Clin Invest(2021),Science Bulletin (2023,2018) ,Comput Struct Biotec J (2022, 2024), BJP(2023), APSB (2023) 等期刊发表一系列研究成果。
(供稿单位:基础医学与临床药学学院;撰写人:高宇,审稿人:沈玲玲、郑诗翌)

