近日,我校工学院顾月清教授、李斯文副教授团队在美国科学促进会(AAAS)出版的Science子刊Science Advances(IF=14.136)发表最新研究成果“A splenic-targeted versatile antigen courier: iPSC wrapped in coalescent erythrocyte-liposome as tumor nanovaccine”。我校硕士研究生翟悦雯同学为本文第一作者,顾月清教授、李斯文副教授为本文的共同通讯作者。中国药科大学为该论文唯一通讯单位。
肿瘤疫苗可通过刺激机体产生非特异性或特异性免疫攻击肿瘤细胞和组织,是目前肿瘤免疫治疗的研究热点之一,但其广谱性、靶向性与高效性有待进一步探究。诱导多能干细胞(iPSCs)有丰富的肿瘤相关抗原(TAA)表位库,这表明基于iPSC的疫苗可以引起广谱的抗肿瘤免疫反应。但完整的iPSCs具有致瘤性,注射入体内后容易被肺等组织截获。因此,提取iPSC蛋白作为广谱的肿瘤相关抗原有利于制备低致瘤性、高免疫原性的肿瘤疫苗。
脾是机体重要的免疫器官,TAA的脾靶向可以激发高效的抗肿瘤免疫反应。此外,作为人体的“血库”,当血液被输送到脾时,衰老或受损的红细胞因失去变形能力会被脾拦截。因此,利用受损的红细胞膜可实现脾靶向。但红细胞膜的低载药率限制了其应用。在此基础上,课题组研究人员用能靶向结合抗原呈递细胞(APCs)表面C型凝集素受体家族的甘露糖修饰脂质体“扩容”红细胞膜,融合药物载体不仅保留了红细胞膜良好的生物相容性和靶向脾功能,而且克服了载药缺陷,并刺激APCs成熟分化,促进抗原向下游T细胞的呈递,开启机体的特异性免疫的“开关”。
在这项研究中,研究人员开发了一种基于红细胞膜与甘露糖脂质体融合并包裹iPSC蛋白的纳米疫苗iPSC@RBC-Mlipo,结果显示该纳米疫苗在小鼠体内表现出明显的脾蓄积,能激发特异性抗肿瘤免疫反应,并有效抑制多种肿瘤模型的生长、转移和复发。因此,该纳米疫苗在肿瘤预防和治疗中具有临床应用前景。
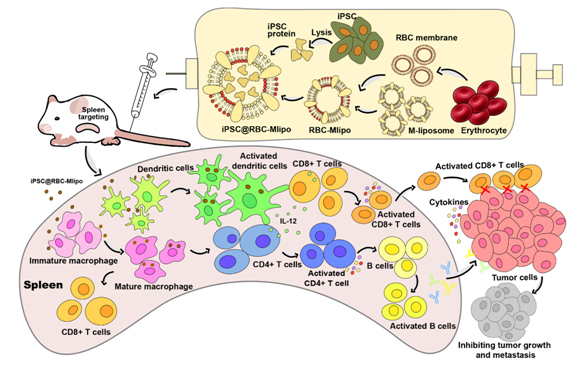
图1 纳米疫苗设计和体内免疫过程示意图
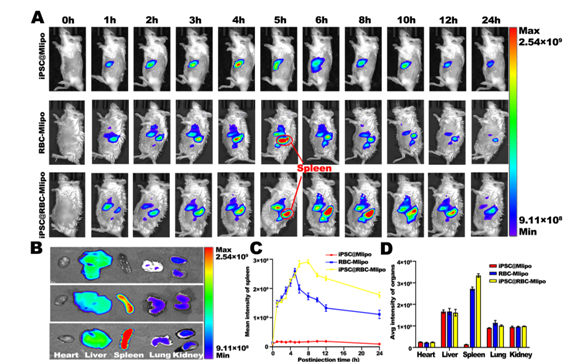
图2 纳米疫苗的脾靶向
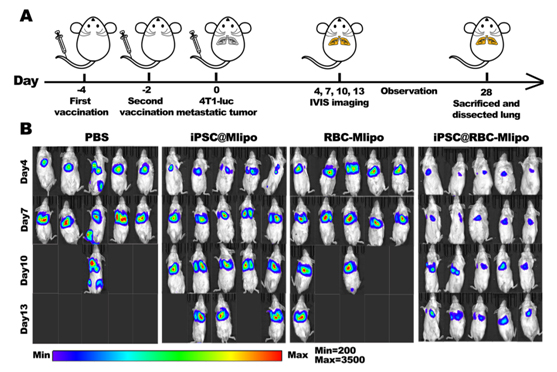
图3 纳米疫苗对肿瘤肺转移的抑制作用
该研究得到了国家自然科学基金面上项目、江苏省自然科学基金-优秀青年项目、江苏省自然科学基金青年项目、国家自然科学基金-国家重大科研仪器研制项目等的资助。
文章链接:https://advances.sciencemag.org/content/7/35/eabi6326
(供稿单位:工学院,撰写人:李斯文、翟悦雯)

