近日,材料学领域权威期刊Nano Letters(IF:12.279)在线发表了中国药科大学药学院姚静教授团队的最新研究成果——Transforming Complexity to Simplicity: Protein-Like Nanotransformer for Improving Tumor Drug Delivery Programmatically(https://dx.doi.org/10.1021/acs.nanolett.9b05008)。师资博士后熊慧为本文的第一作者,姚静教授为本文的通讯作者。
纳米药物递送系统通过提高药物递送效率可以改善肿瘤药物的治疗效率。然而,网状内皮系统的清除、肿瘤组织深层渗透困难、肿瘤细胞摄取效率较低、溶酶体中的药物失活以及释药迟滞等体内递药屏障或技术壁垒仍然制约着纳米药物的发展。根据木桶定律,纳米药物在穿越上述屏障的任一环节受阻均会降低药物的总体递送效率,从而削弱药物的最终治疗效果。尽管肿瘤微环境响应型的纳米药物递送系统,可以通过多次转换其亲疏水性或者尺寸大小以逐层贯穿这些递药屏障,然而以往药物递送系统的构建往往需要依赖于结构复杂且未经FDA批准的新型合成生物材料。此外,其所含敏感键多依赖于化学或者生物反应的完全发生。因此,这些递药系统产业转化技术壁垒大且敏感型转换效率仍然受限。为解决上述问题,姚静教授团队受蛋白质变性和复性的启发,开发了一种具有质子触发的亲疏水-尺寸转换特性及光热疗法(PT)介导的肿瘤深部递送效应的瞬时转换纳米组装体。该瞬时转换纳米组装体的构建,仅需以FDA批准的药物阿霉素,单宁酸和吲哚菁绿为构建单元,经π-π相互作用及静电作用组装为DTIG纳米转换体。研究表明,DTIG纳米转换体在血液循环的中性环境下为亲水性且具有良好的稳定性,而在肿瘤微环境(pH6.5)及酸性溶酶体内(pH4.5)由于质子的触发可瞬时转换为疏水性大尺寸纳米颗粒,在DTIG纳米转换体撕裂溶酶体膜发生逃逸后进入细胞质环境时可再次快速恢复亲水性小尺寸特性,从而达到连续贯穿递药生物屏障的效果。该DTIG纳米组装体结合激光治疗具有良好的化疗与PT联合治疗效果以及肿瘤深层药物渗透效应,且可以有效改善预后。本研究为开发纳米药物提供了一种程序化地突破不同的肿瘤靶向药物递送屏障的新策略。
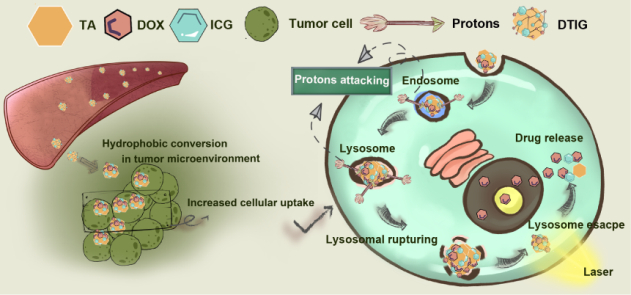
纳米药物DTIG的递药作用机制
(供稿单位:药学院,撰写人:熊慧、王子函)

