近日,我校药学院孙敏捷教授团队在美国科学促进会(AAAS)出版的Science子刊Science Advances(影响因子12.804)发表最新研究成果“Targeting pulmonary tumor microenvironment with CXCR4-inhibiting nanocomplex to enhance anti-PD-L1 immunotherapy”。该论文第一通讯单位为中国药科大学。我校博士研究生李昭廷同学为本文第一作者,孙敏捷教授为通讯作者。
2018年,美国科学家詹姆斯·艾利森(James P. Allison)和日本科学家本庶佑(Tasuku Honjo)获得诺贝尔生理学或医学奖,以表彰他们在发现抗肿瘤免疫检查点治疗中所做出的贡献。近年来,免疫检查点阻断治疗突飞猛进,各种抑制剂层出不穷。尽管此类抑制剂的使用在治疗特定类型的癌症中取得了显著疗效,但目前抗PD-1/PD-L1免疫检查点疗法仍然对大部分患者无效,其治疗的响应率依旧受到很大程度的限制。其中,肿瘤微环境T淋巴细胞浸润不足是限制抗PD-1/PD-L1免疫疗法的关键因素。此外,高度免疫抑制的肿瘤微环境会降低效应T细胞的活化状态而限制抗PD-1/PD-L1免疫疗法的响应率。因此,努力解决这些问题,打破抗肿瘤免疫检查点治疗的桎梏,从而提出新的治疗策略已成为当今抗肿瘤免疫治疗的重中之重。
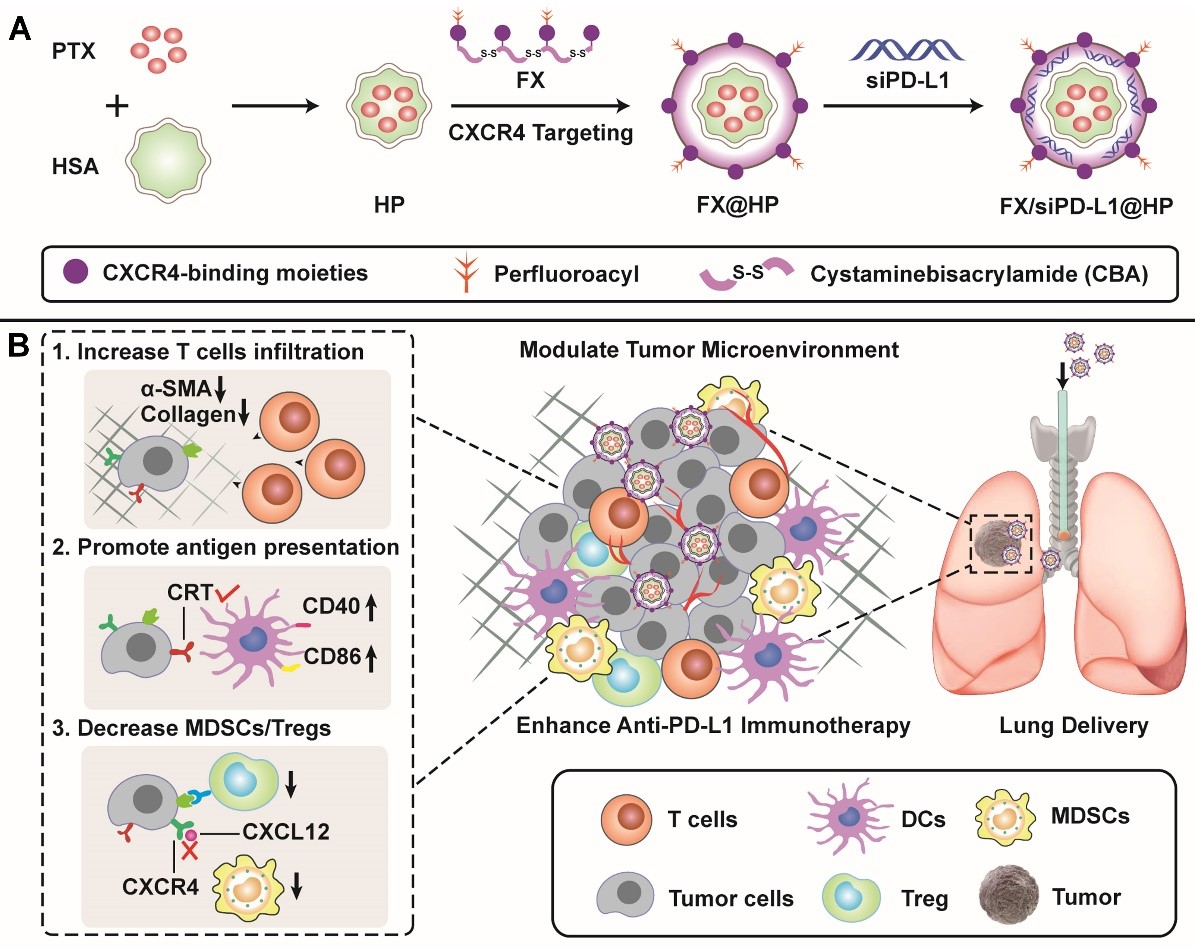
在本研究中,课题组研究人员成功开发了一种CXCR4拮抗的免疫调节纳米制剂(FX/siPD-L1@HP),并采用肺部给药的方式来递送该纳米制剂,以增强抗PD-L1免疫疗法,用于治疗原位Lewis肺癌和乳腺癌肺转移。最为重要的是,研究人员发现该纳米制剂对CXCR4的抑制作用可减弱肿瘤胶原沉积及纤维化并促进效应T淋巴细胞浸润,进而增强抗PD-L1免疫疗效。在抗肿瘤免疫机制研究中发现,FX/siPD-L1@HP能够增加钙网蛋白(CRT)在肿瘤细胞表面的暴露,促进树突状细胞的成熟和抗原递呈,从而增强免疫反应的正向调节。与此同时,FX/siPD-L1@HP可以降低肿瘤微环境中的髓样抑制细胞(MDSCs)和调节性T细胞(Tregs),减少TGF-β和IL-10的分泌,从而减弱免疫反应的负向调节。综上,研究人员在错综复杂的肿瘤免疫微环境中寻找到限制免疫检查点阻断治疗的关键因素,选择与之密切相关的趋化网络信号轴(CXCR4/CXCL12)为调控干预靶点,在课题组前期多策略干预CXCR4通道调控肿瘤微环境的研究基础上,深入挖掘该靶点与抗PD-L1免疫阻断治疗的潜在联系,同时利用药剂学组装技术,实现全方位、多层次的免疫调控,从而为突破临床免疫检查点治疗的瓶颈提出了新的方向和思路。
|
纳米制剂FX/siPD-L1@HP组装及肺部给药作用机制
该研究得到了国家重大研发计划“纳米专项”、国家自然科学基金面上项目、江苏省杰出青年科学基金、中国药科大学“双一流”建设项目基金等资助。特别感谢中国药科大学天然药物活性组分与药效国家重点实验室提供的研究平台支持。文章链接:https://advances.sciencemag.org/content/6/20/eaaz9240。
(供稿单位:药学院、科学技术处,撰写人:李昭廷)