近日,我校肖易倍/陈美容/陆美玲团队在长片段基因敲除工具的机制和开发方向取得研究进展,成果分别发表于一流期刊Cell Research(IF: 28.1)和权威期刊Nature Communications(IF: 14.7)。
超过98%的人类基因组是非编码序列,这些顺式作用元件对基因调控和某些疾病的发生发展至关重要。然而,由于缺乏合适的长片段基因敲除工具,目前绝大部分的长片段非编码序列的功能尚未阐明。不同于Cas9这类基因编辑工具在RNA引导下于基因特定位点产生双链DNA断裂,细菌中还存在一些由核酸酶和解旋酶偶联的蛋白,可在其解旋酶的带动下,由核酸酶对DNA进行持续切割,最终实现长片段的DNA敲除。
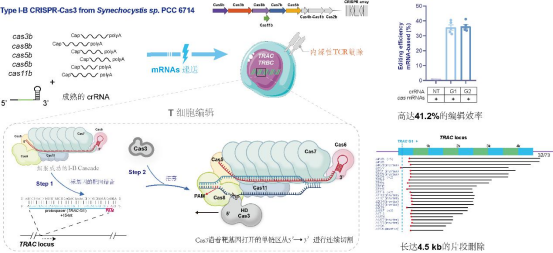
I型CRISPR-Cas系统是数量最多的1类系统,分为I-A到I-G7种亚型。这类系统利用多亚基效应复合物Cascade和解旋酶-核酸酶Cas3靶向和降解外源核酸。陆美玲、肖易倍联合深圳市第三人民医院杨振煌博士共同通讯在Nature Communications发表题为“Structure and genome editing of type I-B CRISPR-Cas”的研究论文,揭示了该系统PAM和靶DNA识别,以及R环形成后效应复合物局部构象变化的分子机制。该研究进一步利用mRNA递送,表征了这种I-B型Cascade-Cas3在人CD3+T细胞中的基因编辑能力,对TRAC位点造成单向4.5kb的缺失,编辑效率可达41.2%。本工作为利用I-B系统在人T细胞中进行长片段基因敲除奠定了基础。
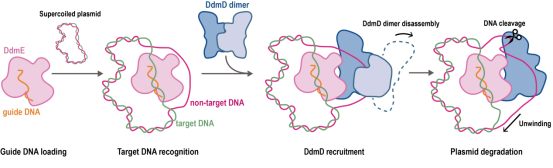
许多细菌中还存在一种DdmDE防御系统用于消除质粒。陈美容、肖易倍共同通讯在Cell Research发表题为“The mechanism of bacterial defense system DdmDE from Lactobacillus casei”的研究论文,阐明了乳杆菌来源的DdmDE防御系统的作用机制。研究表明,DdmDE系统的机制与I型CRISPR-Cas系统的分子机制有显著的相似和不同之处。在I型CRISPR-Cas系统中,RNA引导多亚基效应复合物Cascade将解旋酶-核酸酶融合蛋白Cas3招募到靶向DNA链上。而DdmDE系统中,DNA引导单亚基的Argonaute蛋白DdmE来招募螺旋酶-核酸酶DdmD靶向质粒DNA。相较于I型CRISPR-Cas系统,DdmDE系统利用DNA向导且组成更为简单,有潜力被改造成新型的长片段基因敲除工具。
该研究工作得到了国家自然科学基金创新研究群体项目(No. 82321005)、国家重点研发计划(No.2018YFA0902000)、科技创新2030重大项目(No. ZX-2021ZD0203404),国家自然科学基金(No.82473977,32471316,32271330)的支持。
全文链接:
https://www.nature.com/articles/s41467-024-48598-2
https://www.nature.com/articles/s41422-024-01042-y
(供稿单位:药学院、生命科学与技术学院,撰写人:肖星宇,审稿人:刘帆)

