1月9日,Advanced Functional Materials(影响因子15.62)在线刊登了我校药学院药剂系涂家生教授、孙春萌副教授团队和大连理工大学孙文副教授团队在靶向肿瘤线粒体代谢取得的最新进展——Sequential Enzyme Activation of a“Pro-Staramine”-Based Nanomedicineto Target Tumor Mitochondria(序贯式酶触发“前体多胺”纳米药物靶向肿瘤线粒体的研究)。我校为第一作者单位,我校博士后杜运爱和博士研究生李亚楠为本文共同第一作者,孙文副教授、涂家生教授和孙春萌副教授为共同通讯作者。
肿瘤细胞通过异常的代谢维持其快速增殖、侵袭及转移。例如葡萄糖与氨基酸摄取失控、氮源需求增加等。线粒体是肿瘤细胞代谢的主要场所,是细胞生命活动的能量供应工厂,同时也是控制细胞程序化死亡中重要的细胞器。肿瘤细胞线粒体与正常细胞线粒体相比,代谢更为活跃,可调控细胞内 ROS、ATP水平、信号传导和细胞凋亡等,因此,线粒体成为肿瘤代谢治疗的重要靶点。
对于目前的抗肿瘤纳米药物来说,如何实现体内长循环、肿瘤部位高效富集、被肿瘤细胞有效摄取并特异性靶向线粒体是其面临的主要挑战。基于上述问题,研究人员巧妙的利用肿瘤病理特点,针对肿瘤细胞外和溶酶体内高表达的β-葡萄糖醛酸酶(β-Glucuronidase, β-G),设计了基于β-G可序贯式活化、逐级靶向肿瘤细胞线粒体的药物递送系统。采用β-葡萄糖醛酸修饰多胺脂质,氯尼达明为抗肿瘤代谢药物,制备成β-葡萄糖醛酸修饰的脂质体。β-葡萄糖醛酸修饰的脂质体可显著提高氯尼达明在大鼠体内循环时间,增加肿瘤组织药物蓄积。在肿瘤组织高表达的β-G活化下,增加肿瘤细胞对脂质体的摄取,触发溶酶体逃逸,电荷驱动进入线粒体内,释放氯尼达明,干扰肿瘤细胞氧化磷酸化,显著降低胞内ATP水平,引起线粒体代谢功能紊乱,诱导肿瘤细胞凋亡,有效地抑制了小鼠乳腺癌增殖与肺部转移,该递送系统对靶向肿瘤代谢治疗纳米药物设计提供了新的思路。
据悉,该研究工作得到了科技部、国家自然科学基金委、中国博士后科学基金、中国药科大学中央高校基本科研业务费等基金资助。
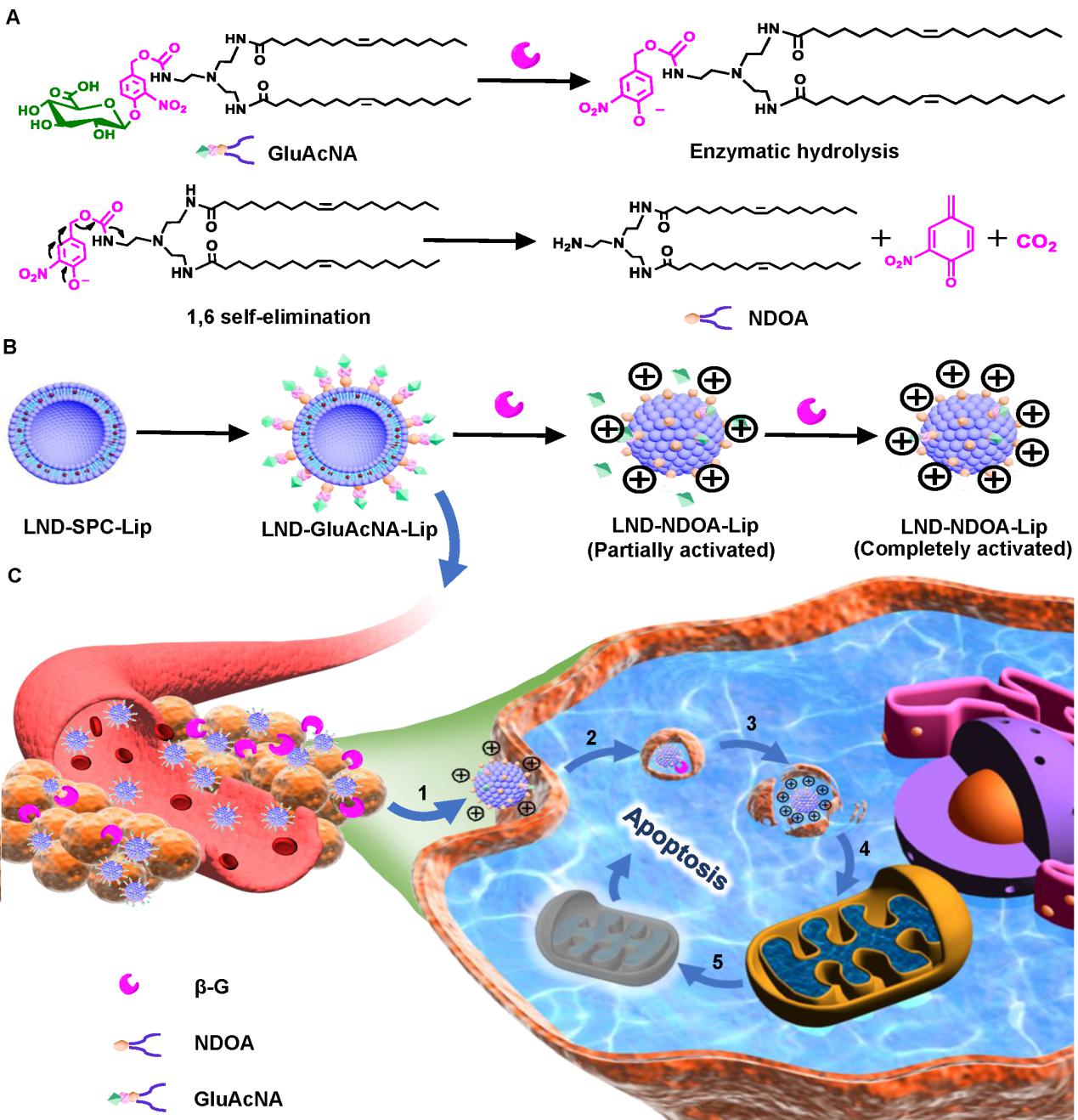
序贯式酶触发前体多胺纳米药物靶向肿瘤线粒体代谢示意图
(供稿单位:药学院,撰写人:杜运爱)

